<rp id="mbqar"></rp> <ol id="mbqar"><optgroup id="mbqar"></optgroup></ol> NEWS
新聞資訊
科研合作
摘要
子宮內(nèi)膜癌是三大婦科惡性腫瘤之一,我國2022年子宮內(nèi)膜癌的新發(fā)病例數(shù)約達7.77 萬例,其中約 1.35 萬例死亡。盡管多數(shù)早期子宮內(nèi)膜癌患者預后良好,但仍有部分患者初診時已是晚期。近年來,免疫治療在子宮內(nèi)膜癌領(lǐng)域取得了一定突破,化療聯(lián)合免疫治療已被證實可改善晚期或復發(fā)性子宮內(nèi)膜癌患者的生存預后。
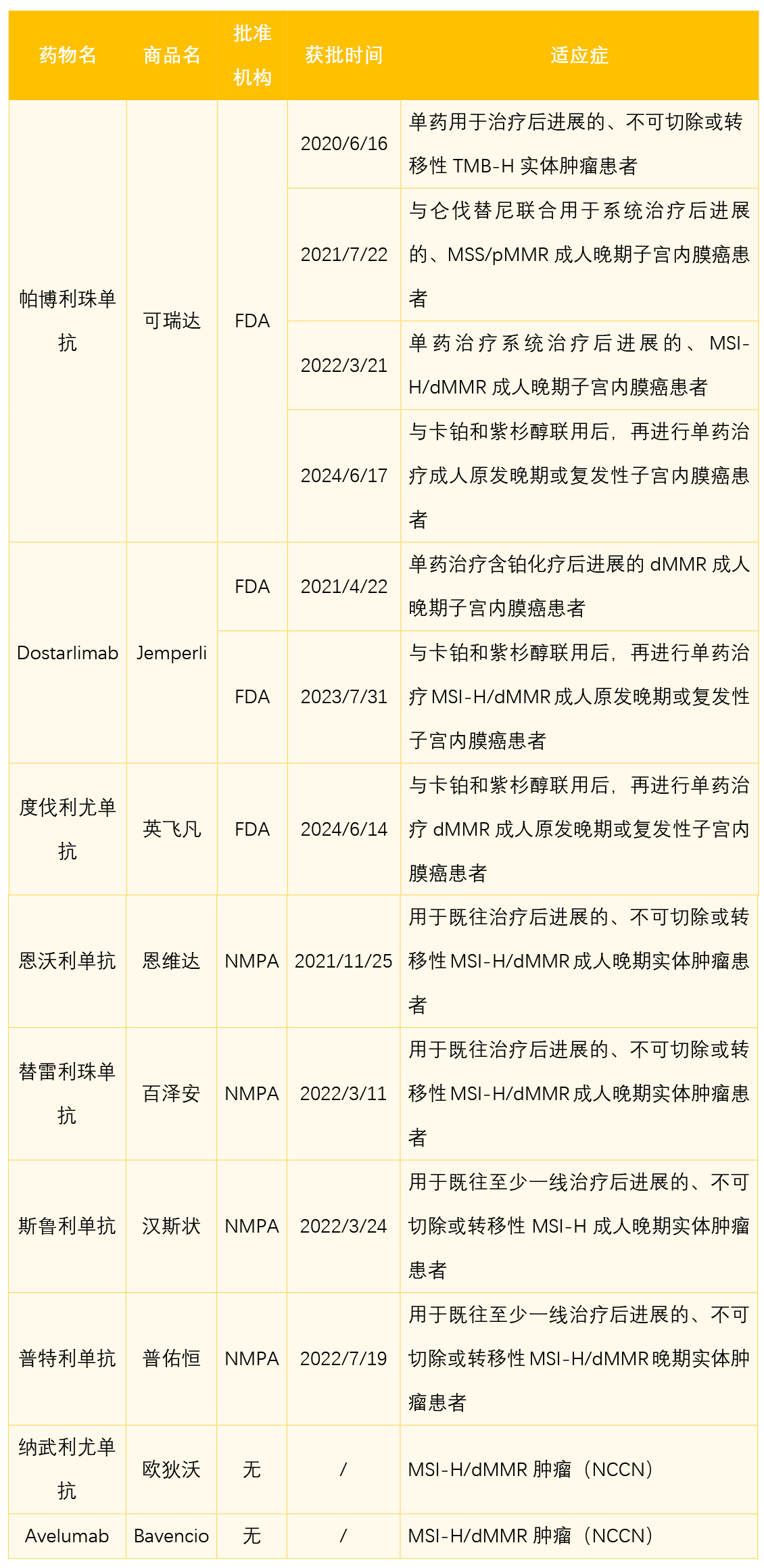
不久前,F(xiàn)DA批準度伐利尤單抗(Imfinzi,英飛凡)用于與卡鉑和紫杉醇聯(lián)用后再進行Imfinzi單藥治療錯配修復缺陷(dMMR)的成人原發(fā)晚期或復發(fā)性子宮內(nèi)膜癌患者。此后不久,F(xiàn)DA批準帕博利珠單抗(Keytruda,可瑞達)用于與卡鉑和紫杉醇聯(lián)用后再進行Keytruda單藥治療成人原發(fā)晚期或復發(fā)性子宮內(nèi)膜癌患者。FDA在短短時間里批準了兩個子宮內(nèi)膜癌一線治療的免疫療法,且在不到一年的時間里批準了三個子宮內(nèi)膜癌一線免疫療法,標志著子宮內(nèi)膜癌的治療全面進入了免疫治療時代。
早期的免疫療法
免疫療法在子宮內(nèi)膜癌中的應用最早可以追溯到2017年5月23日,F(xiàn)DA加速批準了Keytruda用于治療后進展的、不可切除或轉(zhuǎn)移性MSI-H/dMMR晚期實體瘤患者。這是首個獲FDA批準的PD-1藥物,也是首個泛癌種療法。該適應癥的獲批基于KEYNOTE-158(NCT02628067)等多項研究。KENOTE-158的生物標志物研究分析了TMB-H患者的療效,以TMB≥10個突變/Mb作為閾值。TMB-H組患者的ORR為29%,非TMB-H組的ORR為6%。內(nèi)膜癌亞組分析中,TMB-H組ORR為47%(7/15),非TMB-H組為6%(4/67)。2020年6月16日,F(xiàn)DA批準了Keytruda單藥用于治療后進展的、不可切除或轉(zhuǎn)移性TMB-H實體腫瘤患者。之后,基于KEYNOTE-775研究(NCT03517449),2021年7月22日,F(xiàn)DA批準了Keytruda聯(lián)合侖伐替尼用于系統(tǒng)治療后進展的MSS/pMMR子宮內(nèi)膜癌患者。KEYNOTE-158研究的隊列D/K納入了90例MSI-H/dMMR的不可切除或轉(zhuǎn)移性子宮內(nèi)膜癌患者,ORR為46%,mDOR未達到(2.9,55.7+),mPFS為13.1個月,mOS未達到(27.2,NR)。據(jù)此,2022年3月21日,F(xiàn)DA批準了Keytruda單藥用于系統(tǒng)治療后進展的MSI-H/dMMR子宮內(nèi)膜癌患者。
治療子宮內(nèi)膜癌的另一款PD-1單抗是Dostarlimab(Jemperli),2021年4月22日,F(xiàn)DA加速批準Jemperli用于含鉑化療后進展的dMMR子宮內(nèi)膜癌成年患者,這一獲批基于多中心、開放標簽的 1 期劑量遞增和隊列擴展研究Garnet(NCT02715284)。MSI-H/dMMR隊列的ORR為45.4%,MSS/pMMR隊列的ORR僅為14.1%。同年8月17日,F(xiàn)DA加速批準其擴展適應癥,用于治療后進展的dMMR實體瘤成年患者。
除了以上FDA批準的適應證,NCCN指南推薦了納武利尤單抗(歐狄沃,Opdivo)和Avelumab(Bavencio)用于MSI-H/dMMR子宮內(nèi)膜癌患者。國內(nèi)先后批準了恩沃利單抗(恩維達)、替雷利珠單抗(百澤安)、斯魯利單抗(漢斯狀)、普特利單抗(普佑恒)用于既往治療失敗的不可切除或轉(zhuǎn)移性MSI-H/dMMR實體腫瘤患者。這些藥物的臨床研究中也納入了一定數(shù)量的子宮內(nèi)膜癌患者。
子宮內(nèi)膜癌的一線免疫療法
2023年7月31日,F(xiàn)DA批準Jemperli用于與卡鉑和紫杉醇聯(lián)用后再進行Jemperli單藥治療MSI-H/dMMR成人原發(fā)晚期或復發(fā)性子宮內(nèi)膜癌患者,這是FDA批準的首個子宮內(nèi)膜癌一線免疫療法。其獲批基于III期RUBY研究(NCT03981796),針對III/IV期dMMR/MSI-H患者,Jemperli組的mPFS為30.3個月,安慰劑組的mPFS為7.7個月,HR為0.29(p<0.0001)。隨訪24個月時,dMMR/MSI-H患者Jemperli組的OS率為83.3%,安慰劑組的OS率為58.7%,HR為0.3。由于Jemperli聯(lián)合化療在全人群中均顯著延長了PFS(HR=0.64,p<0.01),OS也有所延長(HR=0.64,P=0.021,但大于預設(shè)的P=0.00177),NCCN指南推薦本療法時并未限制必須為MSI-H/dMMR患者。
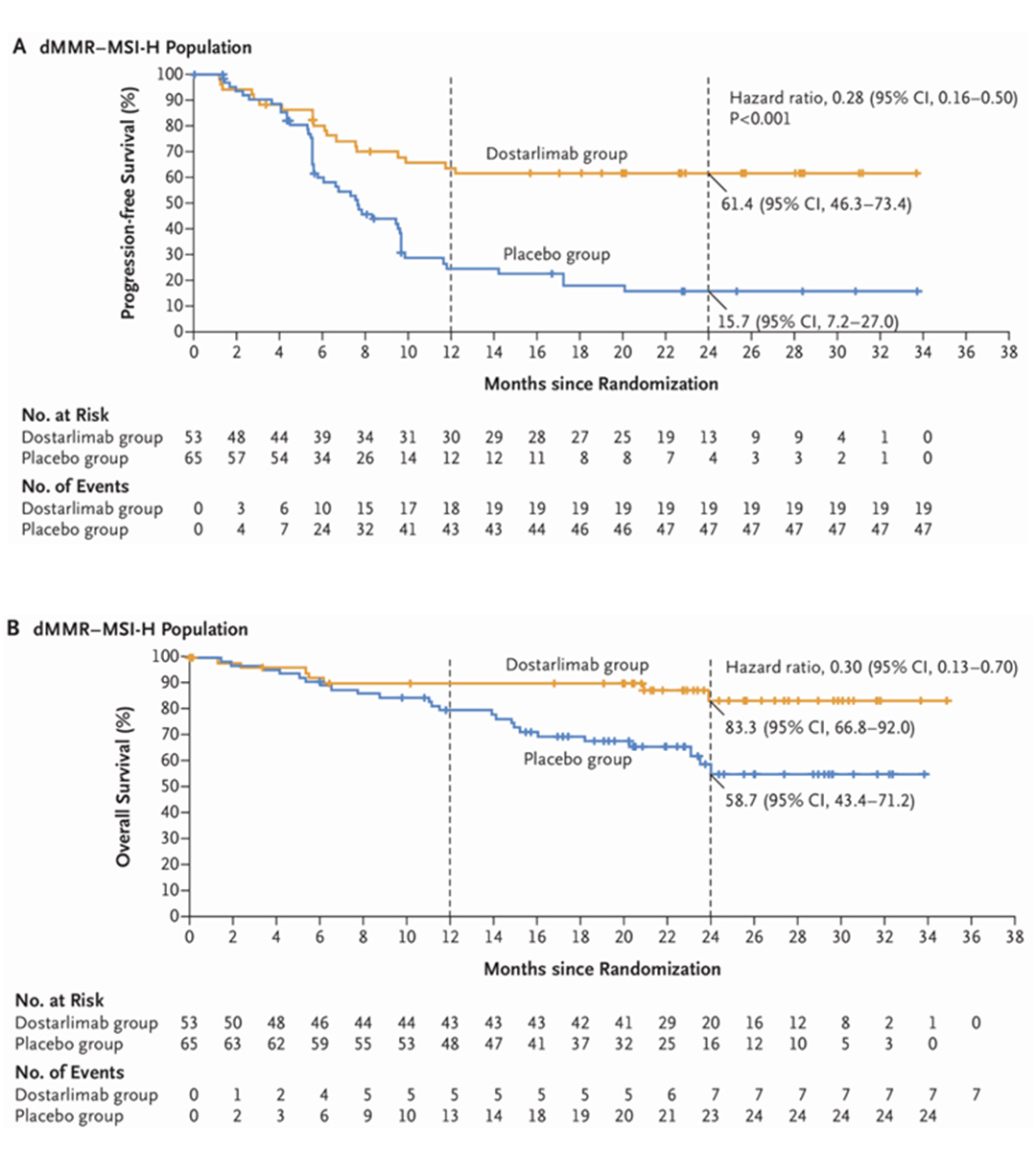
MSI-H/dMMR患者的PFS和OS
Imfinzi是首個獲批子宮內(nèi)膜癌適應癥的PD-L1單抗,其獲批基于III期DUO-E(NCT04269200)研究。研究納入了初診III/IV期和復發(fā)患者,設(shè)置了化療,Imfinzi+化療后Imfinzi單藥維持治療,以及Imfinzi+化療后Imfinzi+奧拉帕利(Lynparza,利普卓)維持治療三個組。在ITT人群中,與對照組相比,Imfinzi組的PFS獲益具有統(tǒng)計學意義(HR=0.71,p=0.003)。在dMMR人群中,Imfinzi組的PFS獲益更明顯(HR=0.42),ORR為71.4%,mDOR未達到(2.4+,26.9+);對照組ORR為40.5%,mDOR為10.5個月。值得一提的是,本次Imfinzi+Lynparza維持治療適應癥未獲批,可能是由于在dMMR人群中,與Imfinzi+化療相比,再加用Lynparza并不能明顯改善PFS(HR 0.42 vs 0.41)。但在ITT人群、pMMR人群和PD-L1陽性人群中,加用Lynparza可以觀察到HR的降低。
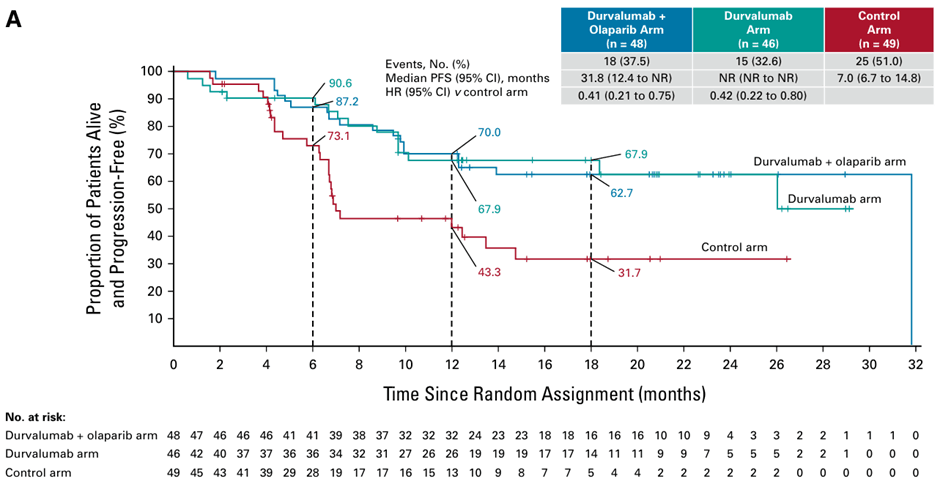
dMMR患者的PFS
Keytruda的新適應癥早在獲批之前,就已被NCCN子宮腫瘤診療指南2023 v2版推薦,其獲批基于III期KEYNOTE-868/NRG-GY018(NCT03914612)研究。研究納入初診III/IV期或復發(fā)性子宮內(nèi)膜癌患者,未納入癌肉瘤患者,因此NCCN指南的推薦排除了癌肉瘤患者。Keytruda聯(lián)合化療證明在dMMR和pMMR人群中均有獲益。dMMR人群中,Keytruda組對比安慰劑組,PFS的獲益具有統(tǒng)計學意義(HR=0.3,p<0.0001);pMMR人群的獲益也具有統(tǒng)計學意義(HR=0.6,p<0.0001)。因此,F(xiàn)DA批準的適應癥并未要求伴隨診斷,但可以看出,dMMR人群獲益更加明顯。

dMMR和pMMR人群的PFS
免疫治療標志物
子宮內(nèi)膜癌患者中有很大一部分適合免疫療法,與其分子機制有關(guān)。一項研究納入了32種腫瘤亞型的12,019個腫瘤樣本,子宮內(nèi)膜癌的dMMR頻率高居榜首。TCGA研究中發(fā)現(xiàn)29%的子宮內(nèi)膜癌為MSI-H高突變型,此外還有7%的POLE超突變型患者。POLE基因也是常見的免疫治療正向因子,2024版NCCN結(jié)腸癌/直腸癌診療指南已將POLE/POLD1突變作為免疫檢查點抑制劑的療效標志物。POLE突變和MSI-H帶來TMB的急劇上升(POLE超突變型為>100個突變/Mb,MSI-H高突變型為10~100個突變/Mb),而且有更顯著的腫瘤新生抗原和TILs水平。
但也并非所有MSI-H的患者免疫治療療效都非常理想。近70%的MSI-H/dMMR子宮內(nèi)膜癌患者是由MLH1基因啟動子區(qū)高度甲基化所致。MLH1甲基化的子宮內(nèi)膜癌患者與高齡、肥胖、晚期疾病顯著相關(guān)。與MMR突變的腫瘤相比,MLH1甲基化腫瘤的TMB和TILs水平較低(P<0.01)。此外,MLH1甲基化腫瘤常見JAK1體系突變,而JAK1是常見的免疫治療負向因子。MLH1甲基化腫瘤免疫治療療效不佳也已通過II期研究(NCT02899793)證實。復發(fā)性MSI-H/dMMR的子宮內(nèi)膜癌患者使用Keytruda單藥治療,Lynch-Like患者的ORR為100%,甲基化患者僅有44%(p=0.024)。3年的PFS為100%比30%(p=0.017),OS為100%比43%(p=0.043)。
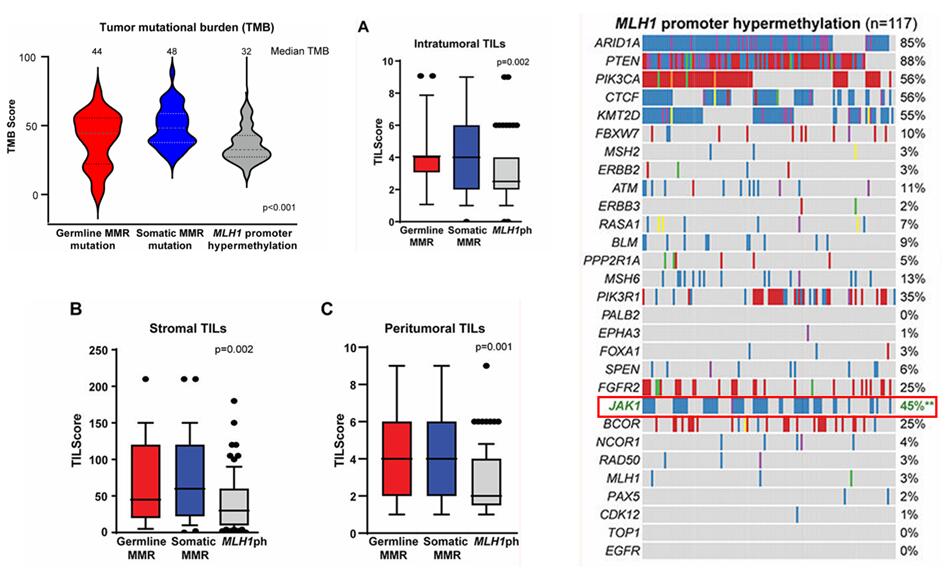
MLH1甲基化腫瘤的TMB和TILs水平較低,常見JAK1突變
總結(jié)
子宮內(nèi)膜癌的免疫療法總結(jié)見下表:
飛朔生物的子宮內(nèi)膜癌分子分型單組織樣本即可檢測MSI,已經(jīng)權(quán)威機構(gòu)認證;亦可提供MLH1基因甲基化檢測,全面提示子宮內(nèi)膜癌患者免疫治療療效。飛朔致力于為腫瘤個體化精準醫(yī)學檢測提供最具創(chuàng)新性的產(chǎn)品和服務,并持續(xù)更新現(xiàn)有產(chǎn)品。
參考文獻
[1] FDA官網(wǎng)數(shù)據(jù)庫
[2] Lancet Oncol. 2020 Oct;21(10):1353-1365.
[3] J Clin Oncol. 2022 Mar 1;40(7):752-761.
[4] J Immunother Cancer. 2022 Jan;10(1):e003777.
[5] NCCN子宮腫瘤診療指南2024 v2
[6] NMPA官網(wǎng)數(shù)據(jù)庫
[7] N Engl J Med. 2023 Jun 8;388(23):2145-2158.
[8] J Clin Oncol. 2024 Jan 20;42(3):283-299.
[9] N Engl J Med. 2023 Jun 8;388(23):2159-2170.
[10] Science. 2017 Jul 28;357(6349):409-413.
[11] Nature. 2013 May 2; 497(7447):67-73.
[12] NCCN結(jié)腸癌診療指南2024 v3
[13] NCCN直腸癌診療指南2024 v2
[14] JAMA Oncol. 2015;1(9):1319-1323.
[15] 中華婦產(chǎn)科雜志2023年10月第58卷第10期
[16] Clin Cancer Res. 2022 Oct 3;28(19):4302-4311.
[17] Cancer. 2022 Mar 15;128(6):1206-1218.